공부하는 북극성
[학생실험] 온도에 따른 황산구리(Ⅱ) 수용액의 전기분해 속도 본문
1. 학습대상
나는 중학교 학생들이 해보고 싶다고 하여 함께해 본 실험인데,
'온도와 반응속도'에 대해 공부하고 있는 학생들이라면
한번 해봐도 좋을 것 같다.
* 관련 개념: 전기분해, 금속의 이온화 경향성, 온도와 반응속도, 활성화 에너지
2. 실험조건
우리 학생들이 실험 조건을 직접 설정하여 실험하였다.
* 사용 용액: 1.0 M 황산구리(Ⅱ) 수용액 100 mL 씩
* 온도 범위: 30 ℃, 45 ℃, 60 ℃, 75 ℃ (15 ℃ 간격)
* 사용 전극: 양극 모두 2 cm * 10 cm * 0.3 mm 구리판
* 사용 전압: 6.0 V
* 반응 지속 시간: 2분 30초
(이것은 반응이 진행됨에 따라 수용액의 온도가 변하였는데, 그 기점이 2분 30초라서 어쩔 수 없었음.)
** 전기분해가 일어나는 계의 사이즈를 키울 수 있다면, 교반하며 사용하는 것 권장.
3. 실험 세팅 모습

250 mL 비이커에 1.0 M $CuSO_4(aq)$ 100 mL 를 넣고
전압을 6.0 V로 고정한 후, 2분 30초간 반응을 지속한 후
전류 세기를 기록하고 양 극을 구성하는 구리판의 질량 변화를 측정했음.
4. 실험 결과① 반응한 구리의 양

1. (-)극, 환원 전극의 질량변화
| 온도(℃) | 30 | 45 | 60 | 75 |
| 처음 질량(g) | 4.93 | 4.98 | 4.95 | 4.79 |
| 나중 질량(g) | 4.95 | 5.01 | 5.00 | 4.86 |
| 질량 차이(g) | 0.02 | 0.03 | 0.05 | 0.07 |
| 석출된 구리 몰수(mol) | 0.0003147326 | 0.0004720990 | 0.0007868316 | 0.0011015642 |
* 석출된 구리 몰 수 구하는 식
구리 몰 수 (mol) = 석출된 구리 질량 (g) * 1/구리 몰질량 (mol/g)
** (+)극의 질량변화가 동일하게 측정되어 따로 표로 정리하지 않음.
2. 각 온도에 따른 전류의 세기
| 온도(℃) | 30 | 45 | 60 | 75 |
| 전류(A) | 0.57 | 0.75 | 0.99 | 1.17 |
전류를 통해 계산한 석출되었어야 하는 구리의 몰수
| 온도(℃) | 30 | 45 | 60 | 75 |
| 전류(A) | 0.57 | 0.75 | 0.99 | 1.17 |
| 전하량(C) | 85.50 | 112.50 | 148.50 | 175.50 |
| 이동한 전자 몰 수(mol) | 0.000886148 | 0.001165984 | 0.001539099 | 0.001818936 |
| 반응한 구리 2가 이온수(mol) | 0.000443074 | 0.000582992 | 0.00076955 | 0.000909468 |
* 전하량 구하는 법
전하량(C) = 전류(C/s) * 시간(s)
* 이동한 전자 몰 수 구하는 법
전자 몰 수 (mol) = 전하량(C) / 패러데이 상수F (C/mol)
(패러데이 상수의 값은 96485 C/mol 로 계산하였음.)
* 반응한 구리 2가 이온수는
$$Cu^{2+}\,+\,2e^{-}\,\rightarrow\,Cu(s)$$
이므로 양적관계에 의해 전자수의 $1 \over 2$에 해당함.
3. 그래프로 표현하기
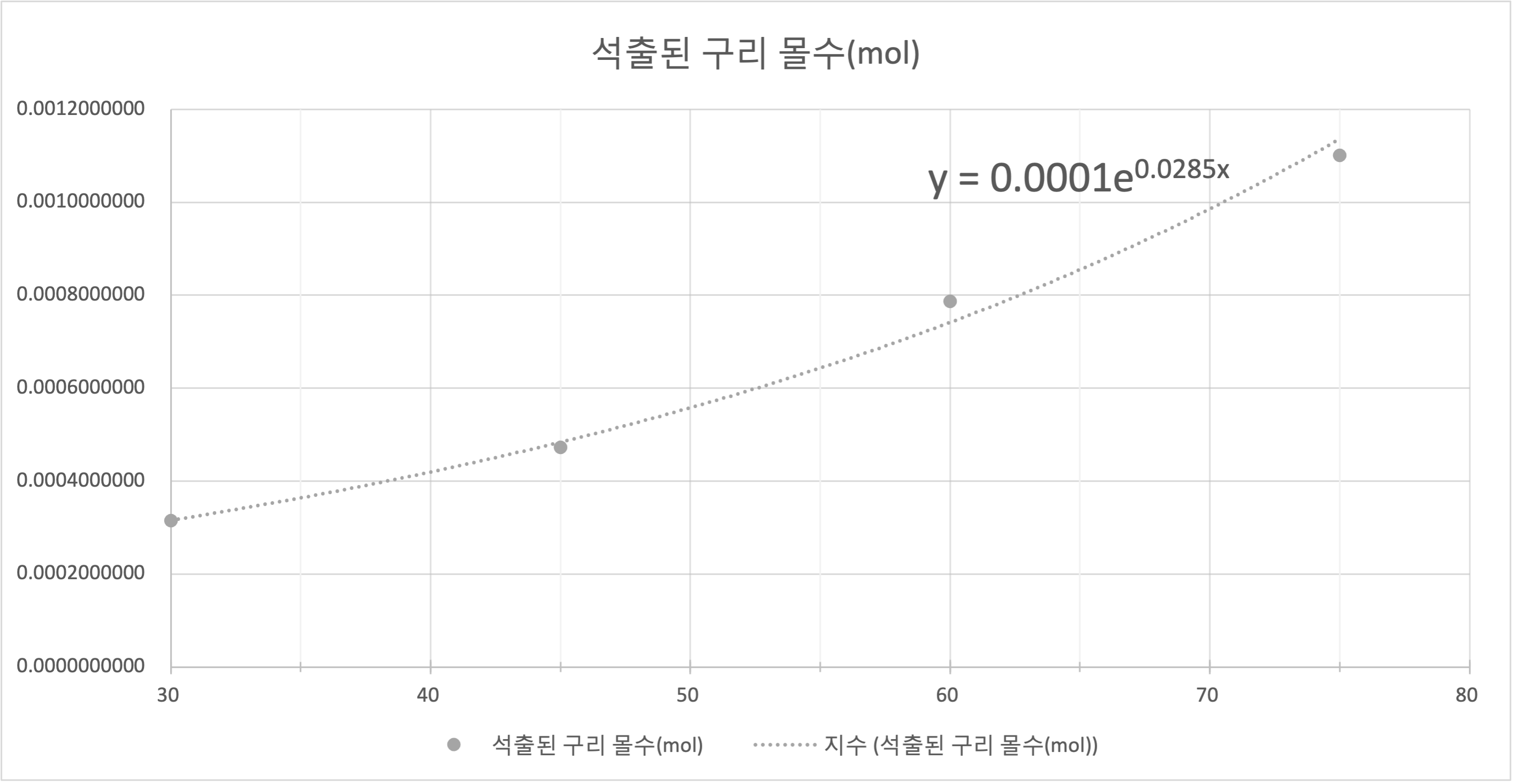

추세선을 지수함수로 그린 이유는
아레니우스 식에 의해 온도 변화에 대해 시간 당 반응한 구리 이온의 수는 지수함수 적으로 증가하여야 하기 때문이다.
4. 질량을 통해 구한 값(실제)과 전류 세기를 통해 구한 값(이론) 사이의 차이?
| 온도(℃) | 30 | 45 | 60 | 75 |
| 질량을 통해 구한 값(실제) | 0.000314732 | 0.000472099 | 0.00078683 | 0.0011015642 |
| 전류세기를 통해 구한 값(이론) | 0.000443074 | 0.000582992 | 0.00076955 | 0.000909468 |
꽤나 일정하게 차이가 났는데,
공급된 전자가 구리 이온을 환원시키는 데 이외의 다른 반응을 하는 데에 사용된게 아닌가 하는 추측을 해 봄.
4. 실험결과 ② 활성화 에너지 구해보기
전기분해에서는 과전위의 크기도 고려를 해줘야한다.
이론적으로 가능한 전압보다 더 크게 걸어줘야하는데, 큰 이유 3가지 중에 고려해볼 만한 것이
활성화 에너지에 의한 과전위이다.
따라서, 아레니우스 식을 이용하여 전기분해 반응에 대한 활성화 에너지를 구해보면
다른 방향으로 수업을 더 전개해볼 수 있을 것 같다.
전극을 다른 것을 써본다거나(활성화 에너지가 반응 표면인 전극의 종류와 관계가 있다)
수용액 자체를 다른 종류로 써보면 비교가 될 것 같다.
$$ v = (A\cdot e^{- {Ea} \over {RT}})\,[Cu^{2+}] $$
에서 $ \frac{v}{[Cu^{2+}]} = c(constant) $ 라고 하면 식을 다음과 같이 바꿀 수 있다.
$$ ln \, c \, = \, ln \,A \, - \frac{Ea}{R} \cdot \frac{1}{T} $$
$ 1 \over T $ 에 대해 $ ln \, c $ 를 도시화하면 다음과 같이 나타낼 수 있다.
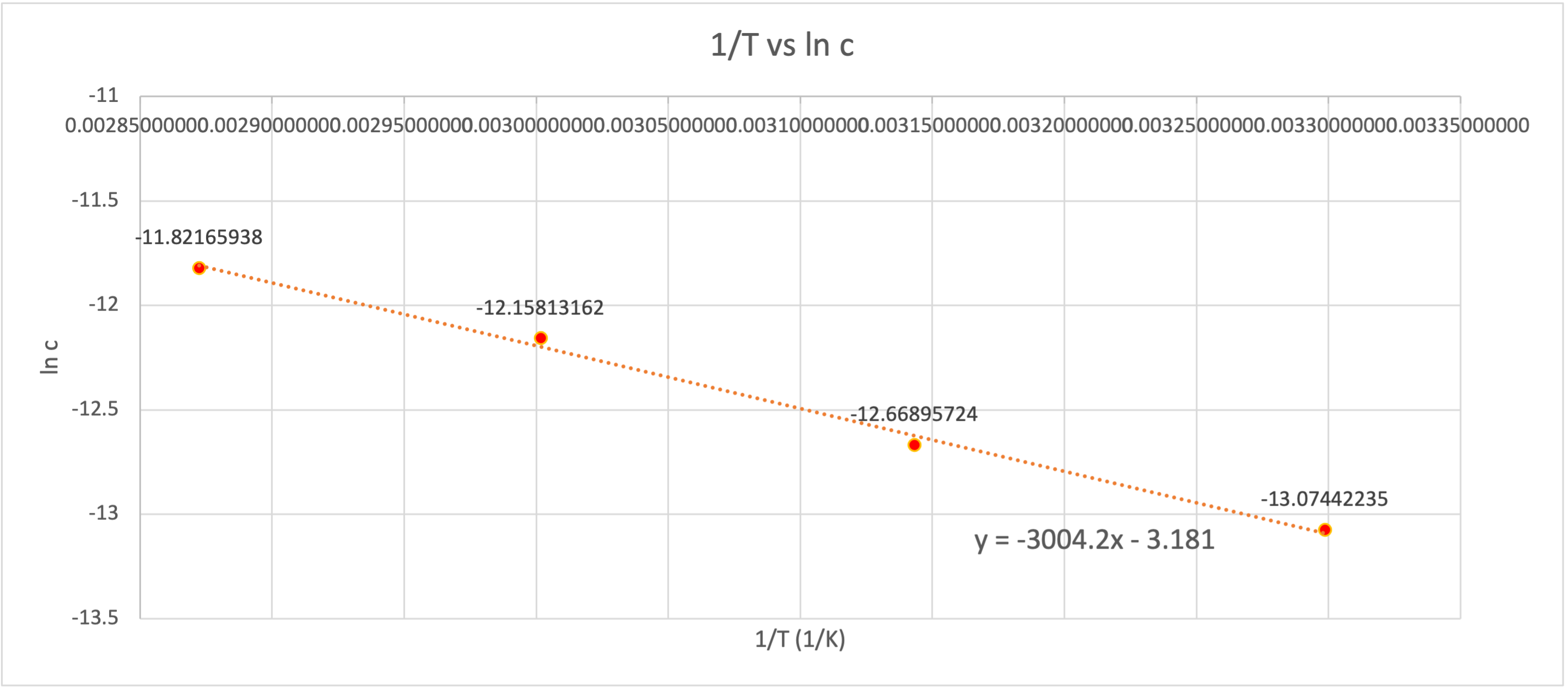
이 그래프에서 기울기는 $ - \frac{Ea}{R} $ 이므로 기울기에 기체상수 $R$ 을 곱하여 활성화 에너지 $Ea$ 를 구할 수 있다.
$$\therefore \, Ea\,=\,3004.2 \,\times\,R(8.314 J/mol \cdot K) / 1000 (kJ/J) = 24.98 kJ/mol $$
마무리
학생들이 조금더 새로운 의미를 창출해내는 탐구를 하기를 바랐으나
나도 없는 창의성을 학생들에게 요구하는 것은 무리가 있었다.
그래서 학생들이 평소에 해보고 싶었다고 했던 전기분해 실험을 진행하면서
조금더 화학 학습에 의미를 부여해보고자 하였다.
온도 변화에 따른 전기 분해 속도 변화 탐구는
반응속도와 전기화학 파트를 엮을 수 있었다는 것에 대해 의미가 있었던 것 같고,
조금더 선행연구를 통해 정확한 활성화 에너지를 찾아 이 실험에 대한 정당성을 부여할 수 있게 된다면
재미없게 다 똑같이 진행되고 있는 '온도에 따른 반응속도 탐구' 에 대한 화학 실험에 다양성을 부여할 수 있을 것 같다.
화학교육의 미래에는 행복하고 꿈이 있는 아이들이 있기를 바라며
이만 마무리한다.
'나누는 삶 > 수업자료' 카테고리의 다른 글
| [양자화학, 파이썬] plotly를 이용한 혼성 오비탈, 혼성 궤도함수 3D plot, 109.5˚의 이유 (1) | 2023.11.05 |
|---|---|
| [양자화학, 파이썬] matplotlib를 이용하여 수소원자의 선 스펙트럼 그리기(라이먼, 발머, 파셴) (0) | 2023.09.11 |
| [양자화학, 파이썬] matplotlib를 이용하여 궤도함수 별 가리움 효과를 설명하기 위한 확률 밀도 함수 그래프 그리기 (1) | 2023.08.12 |
| <중3 과학> 귀의 구조, 코의 구조, 혀의 구조, 피부의 구조/감각기관의 구조/귀의 구조 수업활동 예시 (11) | 2021.09.06 |
| <중2 과학> 2단원 전기와 자기 수업지도안/전기력/정전기유도/번개의원리 (1) | 2021.08.22 |




